Mise au point sur la recherche de mutations de fusion permettant d’accéder aux thérapies ciblées
La recherche de transcrits de fusion à visée théranostique prend une place de plus en plus importante en médecine de précision du fait de l’accès à des thérapies ciblées avec AMM ou disponibles en accès précoces ou dans les essais. Ces fusions sont le plus souvent retrouvées avec une faible fréquence dans un même type tumoral (1 à 5 %) et sont également « agnostiques », c’est-à-dire retrouvées dans différents types tumoraux. A contrario, un même type tumoral peut présenter différents types de fusions, par exemple le carcinome bronchique non à petites cellules (CBNPC) avec les fusions de ALK, ROS1, RET, NRG1, NTRK1, NTRK2, NTRK3.
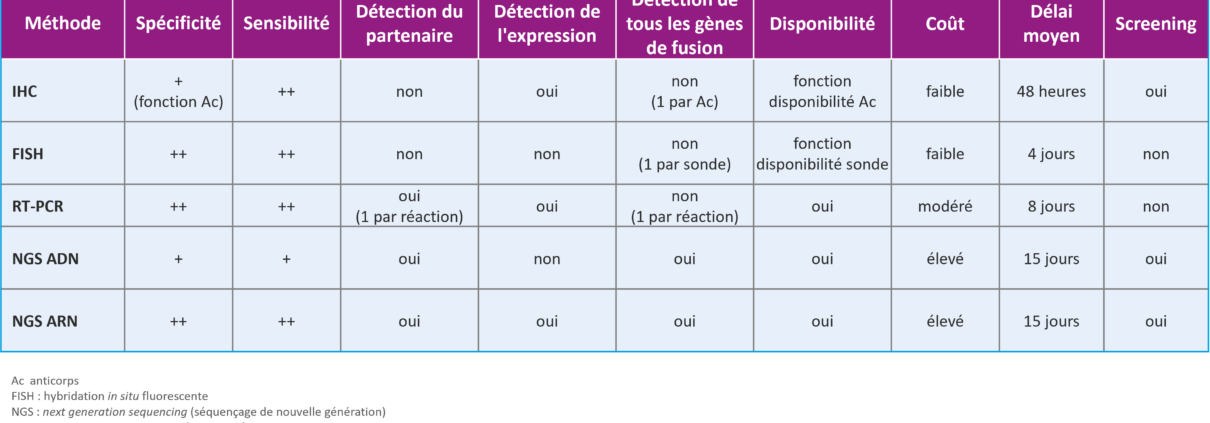
Différentes techniques de mise en évidence de ces fusions sont disponibles et détaillées ci-dessus. Les techniques comme l’immunohistochimie (IHC), l’hybridation in situ fluorescente (FISH) et la RT-PCR sont limitées à l’étude d’une cible, à l’opposé des techniques de NGS ADN ou ARN qui sont plus exhaustives et permettent de rechercher l’ensemble des fusions d’intérêt au sein d’une même tumeur ainsi que d’autres anomalies (mutations +/- variations du nombre de copies).
L’IHC est une technique de screening rapide et peu couteuse mais sa spécificité dépend de l’anticorps et du gène étudié. Par exemple, une surexpression peut être la conséquence d’une fusion mais aussi d’une amplification ou d’une mutation du gène. Ainsi, la détection d’une surexpression de la protéine ne sera pas forcément spécifique d’une fusion (à l’exception de l’IHC ALK 3+ dans le CBNPC pour lequel les études ont montré une excellente corrélation avec la présence d’une fusion). A l’inverse, la sensibilité de l’IHC peut être mise en défaut (faux-négatifs) soit en raison du partenaire lui-même (niveau d’expression faible en raison d’un partenaire faiblement exprimé), soit en raison de l’anticorps lui-même ou de problèmes techniques (fixation, conservation de l’échantillon…). L’utilisation de l’IHC doit donc faire l’objet d’une mise au point préalable et d’un contrôle continue de qualité.
La FISH et la RT-PCR ont une bonne sensibilité et spécificité dans la limite des sondes utilisées pour la FISH et du multiplexage des amorces pour la RT-PCR. La FISH peut être intéressante pour confirmer une anomalie suspectée en IHC, par exemple. La RT-PCR quant à elle, est limitée à l’étude d’un panel de quelques transcrits de fusion connus. Ces 2 méthodes ne sont donc pas exhaustives et ne seront pas des techniques de choix de screening.
Finalement le NGS s’avère avoir la meilleure rentabilité pour rechercher sans « à priori » au sein d’une tumeur donnée, de multiples transcrits connus dans différents types tumoraux mais également d’identifier de nouvelles fusions non décrites. Ceci le place à la fois comme une technique exhaustive et comme une méthode de screening. Le NGS ARN a une meilleure sensibilité et spécificité que le NGS ADN car ce dernier peut être pris en défaut pour certains gènes dont les régions introniques sont de grande taille comme par exemple NTRK2 et NTRK3 tandis que le NGS ARN ne sera pas gêné et détectera facilement les transcrits de fusion qui par définition ne comportent que les régions exoniques. D’autre part, le NGS ADN peut mettre en évidence des réarrangements ne correspondant pas à des fusions oncogéniques qui seront difficiles à interpréter, tandis que le NGS ARN grâce à l’analyse de l’expression permettra de s’assurer de l’impact du réarrangement et que le transcrit de fusion est bien exprimé par les cellules tumorales.
On pourrait opposer au NGS son coût plus élevé et ses délais de réalisation plus longs que les précédentes techniques, cependant au final, il est plus informatif et plus rentable de faire un NGS que de réaliser de plusieurs techniques successives qui resteront toujours non exhaustives. Le NGS permet ainsi d’établir une véritable carte d’identité tumorale indispensable à une prise en charge de médecine de précision et à l’accès à de nouvelles molécules ciblées.